PERGUNTA: Como se faz a conversão de unidades nas concentrações molar e comum?
Free List 3 – Q 1 – 2.5. 10-3 mol of sulfuric acid was added to 10 ml of a solution of the same acid
of concentration 294 g/l. The volume of the mixture was made up with water until
650 ml of solution was reached. The resulting solution will be:
Data: H = 1; S = 32; O = 16
a) 4,9 g/L
b) 5,5 mol/L
c) 4,52 g/L
d) 2,8 mol/L
e) 4 . 10-2 mol/L
RESPOSTA: Inicialmente há um sistema com:
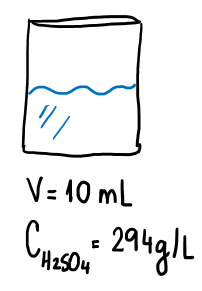
A partir daí é possível calcularmos a massa e o número de mol de H2SO4 que está ionizado nesse sistema:
1L solução ————— 294 g H2SO4
0,01 L solução ———– m g m g = 2,94 g de H2SO4
Se 1 mol de H2SO4 tem 98 g, daí:
1 mol ————– 98 g
n mol ————- 2,94 g n mol = 0,03 mol de H2SO4
A esse sistema foram adicionados 2,5 x 10 – 3 mol de H2SO4 e o seu volume foi completado com água até ser atingido 650 mL:
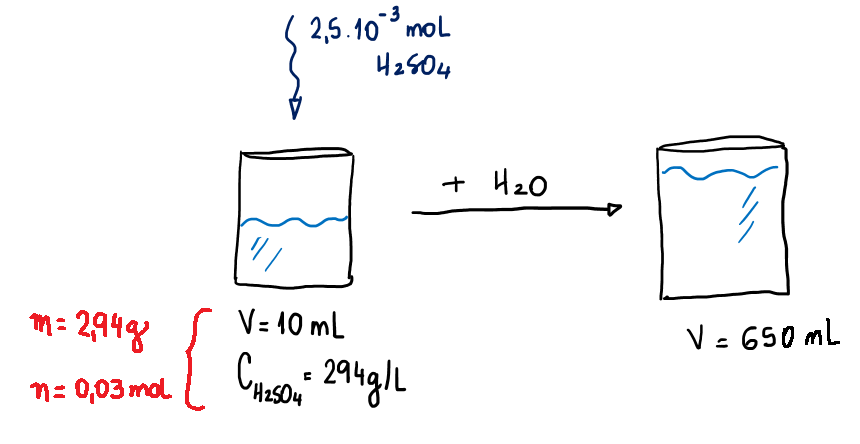
Transformando a nova quantidade em mol de H2SO4 dissolvida em massa, temos:
1 mol de H2SO4 ————- 98 g
2,5.10-3 mol —————– m g m g = 0,245 g
Assim, no sistema final há:
- 0,03 mol + 2,5. 10-3 mol = 0,0325 mol de H2SO4 que equivalem a 2,94 g + 0,245 g = 3,185 g de H2SO4.
- 650 mL de H2O.
Calculando as concentrações molar e comum, teremos:
C = m/V
C = 3,185/0,65 = 4,9 g/L
ou
[H2SO4] = n/V
[H2SO4] = 0,0325/0,65 = 0,05 mol/L
Alternativa: a




