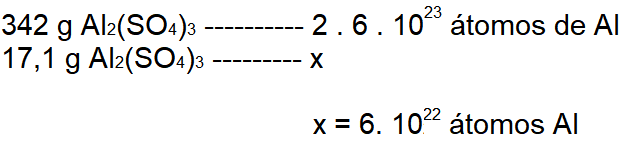PERGUNTA: Quantos átomos de alumínio há em 17,1 g de sulfato de alumínio?
RESPOSTA: A fórmula do sulfato de alumínio é: Al2(SO4)3, daí percebemos que para cada 1 fórmula de Al2(SO4)3 há 2 átomos de Al, portanto para 1 mol de fórmulas do Al2(SO4)3, temos 2 mol de átomos de alumínio.
Assim, para relacionarmos a massa da amostra com o número de átomos de Al contidos nela, devemos, calcular a massa molar (M) do sulfato de alumínio. Sendo, MAl = 27 g/mol; MS = 32 g/mol e MO = 16 g/mol, a massa de 1 mol de Al2(SO4)3 é 342 g/mol, logo teremos:
1 mol Al2(SO4)3 ————– 342 g ———— 2 mol de átomos de alumínio
1 mol Al2(SO4)3 ————– 342 g ———— 2 . 6 . 1023 átomos de alumínio